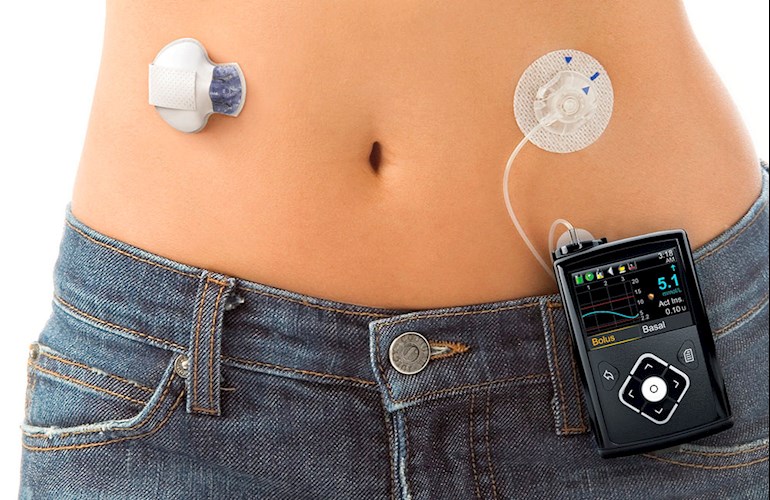
MiniMed 670G, da Medtronic, é formado por uma bomba de medicamentos, um sensor que mede a cada cinco minutos a taxa de açúcar no organismo e um cateter que aplica o hormônio quando necessário.
A FDA, agência reguladora americana de alimentos e medicamentos, aprovou a comercialização de um dispositivo que funciona como um pâncreas artificial para pacientes com diabetes tipo 1.
O aparelho mede automaticamente a taxa de açúcar no sangue dos pacientes e ‘aplica’ insulina, o hormônio cuja produção natural fica deficitária em pessoas com diabetes, quando necessário.
O diabetes tipo 1 é uma doença autoimune, causada pelo próprio organismo, que destrói as células que produzem insulina.
A vasta maioria da população possui diabetes tipo 2, causada pela dificuldade do organismo de absorver a insulina produzida. Ela é mais frequente em pessoas acima do peso e após os 30 anos, embora seu diagnóstico tenha aumentado entre jovens. Predisposição genética, hábitos alimentares, sobrepeso e stress podem ser gatilhos para os dois tipos de diabetes.
Os dispositivos disponíveis atualmente permitem que bombas de insulina façam injeções nos pacientes após a leitura dos monitores glicêmicos, mas os dois componentes não são conectados. É justamente a união destes dispositivos ao corpo do paciente que forma o “pâncreas artificial”.
O MiniMed 670G, da Medtronic, é formado por uma bomba de medicamentos, um sensor que mede a cada cinco minutos a taxa de açúcar no organismo e um cateter que aplica o hormônio quando necessário.
Apesar da autonomia proporcionada pelo dispositivo, ele não é totalmente automático nem livre de riscos. Seus usuários ainda precisam solicitar manualmente mais insulina depois de comer e os efeitos colaterais associados ao seu uso são hipoglicemia, hiperglicemia e irritação da pele.
A aprovação da FDA permite o uso do dispositivo por pacientes a partir dos 14 anos, mas a empresa afirmou que já está estudando a possibilidade de uso por crianças mais jovens e disse que o MiniMed deve estar disponível para compra em março de 2017 (início da primavera no hemisfério norte).
Fonte: veja.abril.com.br/