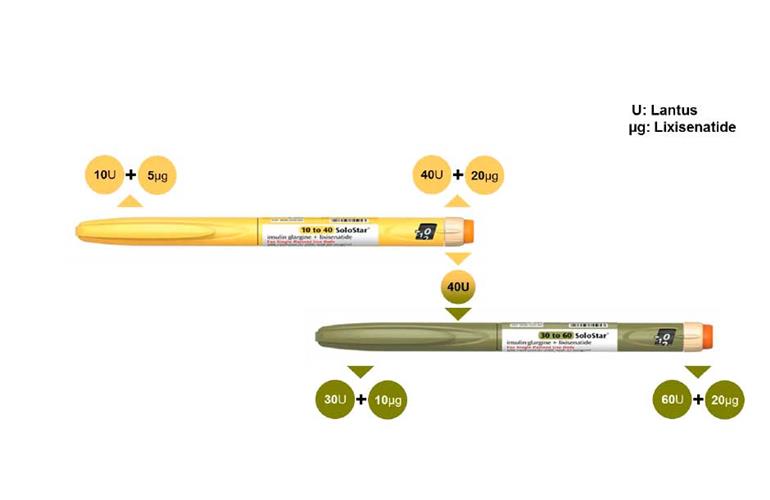
A nova droga de combinação da Sanofi, deverá utilizar duas canetas para sua aplicação .
Um dia depois de recomendar a aprovação de uma nova droga para diabetes feita pela Novo Nordisk A / S, um painel consultivo do FDA recomendou a aprovação de um produto semelhante desenvolvido pela Sanofi SA.
O painel votou por 12-2, com uma abstenção, para que a Food and Drug Administration (FDA) aprove a droga de combinação, iGlarLixi, da Sanofi, para pacientes com diabetes tipo 2. A agência não é obrigada a seguir o conselho de seus painéis consultivos, mas normalmente o faz.IGlarLixi combina a droga insulina Lantus da Sanofi com seu tratamento experimental do diabetes, lixisenatida, membro de uma classe de drogas conhecidas como GLP-1 agonistas que também inclui Victoza da Novo Nordisk, Byetta da AstraZeneca Plc e Bydureon da Bristol-Myers Squibb Co.
As empresas argumentam que o tratamento mais cedo e de forma mais agressiva pode evitar complicações da diabetes, uma doença metabólica crônica que afeta mais de 22 milhões de pessoas nos Estados Unidos e que pode levar a doenças cardíacas, cegueira e amputações de membros.iGlarLixi, a combinação de drogas da Sanofi, foi recebida com mais frieza pelo painel do que a combinação da Novo Nordisk, iDegLira.
Os painelistas ficaram particularmente preocupados com a forma como a droga da Sanofi seria embalada e rotulada. As doses são aplicadas separadamente e seriam entregues em duas canetas de injeção diferentes.
Dr. Robert Smith, um professor de medicina na Universidade de Brown e presidente do painel, votou a favor da droga, mas como os outros no painel, disse que seu voto foi condicionado à empresa tratar adequadamente as preocupações de que as duas canetas poderiam confundir o paciente, levando a erros de medicação.
“Há um monte de preocupações com os perigos que vêm com isso”, disse Smith. “Nós não estamos contestando a construção, mas há um verdadeiro desafio aqui e teremos de rotulá-lo de forma adequada”.Lixisenatida por si só é uma droga experimental.
O painel discutiu as preocupações do FDA de que a droga poderia causar mais reações alérgicas do que outros na classe, mas eles estavam convencidos de que sua segurança e eficácia estava amplamente alinhada com outros em sua classe.O painel não levantou objeções à aprovação da lixisenatida e, especificamente, recomendou a aprovação do iGlarLixi. Painelistas disseram que preferem dar iGlarLixi a aqueles doentes que já estavam tomando insulina ou um medicamento GLP-1.Mas eles disseram que gostariam que a empresa realizasse um estudo adicional para confirmar que os pacientes que transição de uma droga GLP-1 fazia tão bem quanto a transição de um produto de insulina.
A decisão de aprovação do FDA para a lixisenatida está prevista para julho e de iGlarLixi em agosto.
Fonte: portal tiabeth - Noticia- Medicamento de 04/06/2016